3.0 ASPECTOS CLÍNICOS
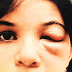
A doença de Chagas apresenta duas fases: aguda e crônica. A fase aguda inicia-se no momento da infecção, caracterizando-se por parasitemia patente (detectável por técnicas parasitológicas rotineiras) e pelos baixos títulos de anticorpos específicos da classe IgG, embora anticorpos IgM possam ser encontrados. A fase crônica inicia-se entre algumas semanas e uns poucos meses depois de adquirida a infecção, caracterizando-se pela ausência de parasitemia patente e por uma intensa resposta imune humoral, com predomínio de anticorpos do tipo IgG. A maior parte das infecções agudas é assintomática ou inaparente. Quando há quadro clínica da doença de Chagas aguda, este se caracteriza por febre baixa e mal estar acompanhados de linfadenopatia e de hepatoesplenomegalia. Podem ser observado sinais associados à porta de entrada do parasito, como o sinal de Romaña (edema bipalpebral unilateral), que sugere a penetração do parasito pela mucosa da conjuntiva, ou o chagoma de inoculação (lesão cutânea eritematosa e endurecida, porém indolor), que se desenvolve no sítio de inoculação do parasito.
A infecção crônica pode ser indeterminada ou sintomática. A forma indeterminada é aquela que segue a fase aguda, aparente ou não, em que o indivíduo permanece assintomático. A forma indeterminada acomete aproximadamente 70% dos indivíduos cronicamente infectados, podendo estender-se por alguns meses ou muitos anos, até o final da vida do paciente. Eventualmente, a forma indeterminada pode evoluir para formas sintomáticas ou determinadas, sendo as mais comuns a cardíaca e a digestiva. Na forma cardíaca, a manifestação clínica mais comum é a insuficiência cardíaca congestiva, acompanhada de alterações eletrocardiográficas típicas, como o bloqueio completo do ramo direito e, frequentemente, o hemibloqueio anterior esquerdo. Em casos avançados ocorre cardiomegalia. Arritmias complexas e morte súbita são relativamente comuns.
Na forma digestiva, a destruição dos plexos nervosos ao longo do tato digestivo produz alterações funcionais e morfológicas principalmente no esôfago, no cólon ou ambos. As manifestações clínicas mais comuns são aquelas associadas ao megaesôfago (disfagia, regurgitação, dor epigátrica) e o megacólon (constipação intestinal crônica, distensão abdominal). Podem também ocorrer formas mistas, onde se associam sintomas cardíacos e digestivos.
Em pacientes imunocomprometidos pode ocorrer a forma cerebral. Nesta, observa-se geralmente meningoencefalite que pode assemelhar-se ao quadro de toxoplasmose, um importante diagnóstico diferencial a ser feito pelo clínico. Quando há manifestações clínicas da doença, em geral se observam infiltrados inflamatórios nos tecidos afetados, mas a carga parasitária em tecidos cronicamente infectados é muito baixa, o que sugere que as lesões teciduais que produzem as manifestações clínicas da doença de Chagas se devem essencialmente a uma resposta autoimune contra células do hospedeiro, desencadeadas originalmente pela presença do parasito. Por outro lado, vem-se observando mais recentemente uma relação direta entre a carga parasitária inicial e a gravidade das lesões teciduais observadas na fase crônica em modelos experimentais, dados que indicam uma participação direta do parasito na patologia.
A doença de Chagas ocorre especialmente na América Latina. Entretanto, nas últimas décadas ela vem sendo cada vez mais detectada nos EUA, Canadá e Europa, especialmente devido a mobilidade populacional entre América Latina e o resto do mundo.
De acordo com dados recentes da Organização Mundial de Saúde, verifica-se infecção por via vetorial desde o sul dos EUA até o sul da Argentina e Chile, abrangendo todos os países da América Central e do Sul, com 7 a 8 milhões de indivíduos infectados, 21.000 mortes anuais e uma incidência de 300.000 novos casos por ano. No Brasil estima-se a existência de 5 milhões de portadores da infecção.
5.0 DIAGNÓSTICO
A origem do paciente e/ou os sinais da porta de entrada do T. cruzi, acompanhados de febre irregular ou ausente, adenopatia satélite ou generalizada, hepatoesplenomegalia, taquicardia, edema generalizado ou dos pés, fazem suspeitar da fase aguda da doença de Chagas. As alterações cardíacas acompanhadas de sinais de insuficiência cardíaca confirmadas pelo eletrocardiograma e as alterações digestivas do esôfago e do cólon (reveladas pelos raios X) fazem suspeitar da fase crônica da doença. Entretanto, em ambos os casos, há necessidade de confirmação do diagnóstico por métodos laboratoriais.
Os métodos laboratoriais de diagnóstico da doença de Chagas apresentam diferentes resultados se aplicados na fase aguda ou na fase crônica da infecção.
Na fase aguda observam-se: alta parasitemia, presença de anticorpos inespecíficos e início de formação de anticorpos específicos (IgM e IgG) que podem atingir níveis elevados. Nesta fase recomenda-se pesquisa direta do parasito, podendo ser feita, entre outras técnicas, por: a) exame de sangue a fresco; b) exame de sangue em gota espessa; c) esfregaço sanguíneo corado pelo Giemsa; d) métodos de concentração; e) xenodiagnóstico e f) hemocultura. Se necessário, a pesquisa indireta do parasito por ser feita, tendo como principais técnicas a reação de imunofluorescência indireta (RIFI) e ensaio imunoenzimático (ELISA). Na fase crônica, observam-se baixíssima parasitemia e presença de anticorpos específicos (IgG), assim, recomenda-se para o diagnóstico métodos sorológicos, como: a) RIFI; b) ELISA; c) reação de hemaglutinação indireta (RHI); d) reação de fixação de complemento (RFC). A Organização Mundial de Saúde (OMS) recomenda que o diagnóstico sorológico da doença de Chagas seja realizado utilizando sempre dois testes sorológicos diferentes em paralelo. A pesquisa do parasito (diagnóstico parasitológico) por métodos indiretos como xenodiagnóstico, hemocultura ou inoculação em animais de laboratório, torna-se especialmente necessária quando a sorologia é duvidosa.
A reação em cadeia de polimerase (PCR) permite a detecção de parasitos no sangue e tecidos de pacientes com elevada sensibilidade mesmo na fase crônica, pois é capaz de detectar quantidades de DNA de uma única célula do parasito. É frequentemente utilizada no contexto de pesquisa, mas ainda não se tornou amplamente disponível em laboratórios de rotina. Para diagnóstico e triagem de doadores de sangue, recomenda-se o uso de ao menos três técnicas sorológicas distintas, das quais devem ser obtidos um mínimo de dois resultados concordantes, para reduzir o risco de reações falso-negativas.
Apesar dos grandes esforços, o tratamento para a doença de Chagas continua parcialmente ineficaz. Diversas drogas vêm sendo testadas em animais e algumas delas têm sido usadas no homem, mas nenhuma consegue suprimir a infecção pelo T. cruzi e promover uma cura definitiva em todos os pacientes tratados.
Outro sério problema enfrentado refere-se as diferenças regionais na susceptibilidade pelo T. cruzi à droga, o que reflete a diversidade genética do parasito. Um ponto, entretanto, deve ser salientado: as drogas são mais eficientes quando aplicadas em esquemas terapêuticos prolongados, para manutenção de níveis duradouros e eliminação das formas sanguíneas até a exaustão das formas teciduais. Duas drogas têm sido utilizadas, apesar dos efeitos colaterais, que incluem anorexia, perda de peso, náuseas, vômitos, cefaléias, polineuropatia, entre outros:
a) Nifurtimox: age contra as formas sanguíneas e parcialmente contra as teciduais. É administrado por via oral, sob a forma de comprimidos. Entretanto, foi recentemente retirado do mercado. b) Benzonidazol: administrado por via oral, sob a forma de comprimidos, atua apenas sobre as formas sanguíneas.
6.1 Alvos para o desenvolvimento de novos medicamentos
Muitos estudos têm sido conduzidos na procura de terapias alternativas para a doença de Chagas, a descoberta de alvos metabólicos para desenvolver medicamentos com ação tripanocida é uma prioridade de pesquisa e desenvolvimento.
Muitos alvos têm sido apontados para o desenvolvimento de novos medicamentos, entre eles: a) Cisteíno-proteases: participam de vários processos celulares fundamentais no ciclo de vida de T. cruzi, como o metabolismo energético, a diferenciação, a invasão da célula hospedeira e a evasão do sistema imune. A cisteíno-protease mais abundante em T. cruzi é a cruzapaína, ausente nos hospedeiros mamíferos.
b) Via de síntese de esteróis: fornece alvos promissores, uma vez que o principal esterol nas membranas de T. cruzi é o ergosterol, e não o colesterol, presente nas células dos hospedeiros mamíferos, possibilitando o desenvolvimento de inibidores seletivos. c) Metabolismo redox: nos tripanossomatídeos apresenta a peculiaridade de basear-se na produção de tripanotiona, uma tiol-poliamina conjugada presente exclusivamente em T. cruzi, em vez da glutationa, fornecendo assim um potencial alvo.
Não há vacina para a doença de Chagas. A principal via de transmissão da doença de Chagas é a vetorial, mas a infecção pode ser adquirida por vias alternativas, que exigem medidas de prevenção específicas. Acredita-se que a transmissão oral tenha maior relevância epidemiológica do que se suspeitava até recentemente, sendo os principais veículos descritos o caldo de cana e a polpa ou suco de açaí e outras palmeiras amazônicas, contaminados durante seu preparo com fezes de triatomíneos infectados.
A transmissão transfusional é extremamente importante em regiões com grande número de doadores de sangue provenientes de áreas endêmicas. A doença de Chagas pode ser também adquirida por via transplacentária (congênita), bem como em acidentes de laboratório ou transplante de órgãos.
O controle vetorial é o método mais efetivo de prevenção da doença de Chagas na América Latina. A análise do sangue de doadores é fundamental na prevenção da transmissão através da transfusão sanguínea e do transplante de órgãos. Os recentes sucessos obtidos no controle da transmissão da doença de Chagas no Brasil devem-se a um programa de eliminação de vetores domiciliados e à melhoria da qualidade do sangue e demais hemoderivados usados em transfusões.
Os inseticidas organoclorados vêm sendo substituídos por piretróides, que apresentam ação residual inseticida e repelente, sendo os ciclos de borrifação a cada 12 meses até a completa erradicação de colônias intradomiciliares de triatomíneos. A prevenção da transmissão transfusional requer a triagem sorológica dos doadores de sangue. O sangue de doadores com resultado positivo ou duvidoso deve ser descartado. O controle da transmissão oral requer medidas de educação em saúde pública sobre os alimentos de risco. Assim, atualmente as medidas profiláticas que podem ser sugeridas são:
i) Melhoria das habitações rurais; ii) Combate ao inseto vetor;
iii) Controle de doadores de sangue e órgão; iiii) Controle da transmissão congênita;
Apesar de todos os estudos e grande melhora do quadro geral nas últimas décadas, a doença de Chagas, ou tripanossomíase americana, continua sendo um grande desafio para a saúde pública atual, sobretudo nas Américas, onde ocorre seu ciclo natural e onde se presencia os maiores danos causados por esta doença, requerendo ainda muitos estudos e investimentos, na busca por métodos diagnósticos seguros e de fácil aplicação, por um tratamento efetivo e no desenvolvimento de uma vacina eficaz.